Screening
Matthias Egger, Marcel Zwahlen, Lotte Habermann-Horstmeier
Die Idee ist bestechend: Im Rahmen von Vorsorgeuntersuchungen wird bei Personen, die sich gesund fühlen festgestellt, ob ein frühes Stadium einer Erkrankung vorliegt. Der Krankheitsverlauf wird darauf durch die frühzeitig einsetzende Therapie günstig beeinflusst, sodass Komplikationen verhindert und die Sterblichkeit gesenkt werden. Ein solches Screening ist mehr als nur die Durchführung einer Vorsorgeuntersuchung. Es umfasst eine ganze Versorgungskette und sollte im Rahmen eines organisierten und evaluierten Screening-Programms stattfinden.
Zu Beginn dieses Lehrbuch-Abschnitts wird – nach einem kurzen geschichtlichen Überblick – der Begriff »Screening« definiert. Anschließend werden die Auswirkungen des Screenings sowie mögliche Fallstricke bei der Evaluation von Screening-Programmen betrachtet. Dabei zeigt sich, dass Screening nicht nur mit einem Nutzen, sondern immer auch mit unerwünschten Auswirkungen verbunden ist. Zum Schluss des Textes werden die in der Schweiz und in Deutschland durchgeführten Screening-Programme kurz vorgestellt.
Alte Schweizerische Lernziele: CPH 10-12
Profiles für das gesamte Kapitel 4:
GO 1.13, GO 1.14, GO 1.23, GO 2.8, GO 2.9, GO 3.3, GO 4.1, GO 4.2, GO 5.2, GO 5.4, GO 6.7, EPA 3.1, EPA 7.4, EPA 9.7
Auf dieser Seite finden Sie die in diesem Kapitel verwendeten Literaturquellen, Hinweise zu empfohlener Vertiefungsliteratur, ergänzende Abbildungen und Boxen sowie weiterführende Internetquellen zum Thema.
Literaturquellen
- Andriole GL, Crawford ED, Grubb RL, et al. Mortality results from a randomized prostate-cancer screening trial. N Engl J Med 2009; 360(13): 1310-1319
- Egger M, Zwahlen M (Ed.). Tumorscreening. Therapeutische Umschau 2013; 70(4); 191-258
- Hugosson J, Carlsson S, Aus G et al. Mortality results from the Göteborg randomized population-based prostate-cancer screening study. Lancet Oncol 2010; 11: 725–732
- Raffle AE, Gray JAM. Screening. Durchführung und Nutzen von Vorsorgeuntersuchungen. Bern: Hans Huber, 2009
- Schroder FH, Hugosson J, Roobol, MJ et al. Screening and prostate-cancer mortality in a randomized European study. N Engl J Med 2009; 360(13): 1320-1328
Empfohlene Vertiefungsliteratur
- Wilson JMG, Jungner AG. Principles and practice of screening for disease. Report No. 3. Geneva: WHO, 1968
- Zwahlen M, Low N, Borisch B, et al. Population-based screening – the difficulty of how to do more good than harm and how to achieve it. Swiss Med Wkly. 2010
- PSA-Bestimmung – Empfehlungen der Schweizerischen Gesellschaft für Urologie (SGU). Stand 6. Januar 2012. Schweiz Med Forum 2012; 12(6): 126–128
- Zwahlen M, Bopp M, Probst-Hensch NM. Mammography screening in Switzerland: limited evidence from limited data. Swiss Med Wkly 2004; 134: 295-306
- Rembold CM. Number needed to screen: development of a statistic for disease screening. BMJ 1998; 317: 307–312
Zusätzliche Abbildungen
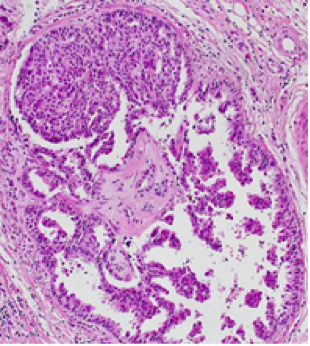
Web-Abb. 4.5.1 Histologischer Schnitt eines duktale Karzinoms in situ (= Wucherung von Tumorzellen in den Milchgängen [Ductuli] der weiblichen Brust)
Quelle: Coya Tapia, Institut für Pathologie, Universität Bern
Zusätzliche Boxen
Web-Box
Mammografie Screening: Der Healthy Screenee-Effekt
In den 1960er Jahren führte ein großer Krankenversicherer in New York, der Health Insurance Plan (HIP), eine umfangreiche, randomisierte Studie durch, um die Wirksamkeit des Mammografie-Screenings zu evaluieren. An ihr nahmen 60.000 Frauen teil. Die der Screening-Gruppe zugeteilten 30.000 Frauen wurden eingeladen, sich jährlich untersuchen zu lassen. In der Folgezeit wurden 67% dieser Frauen mindestens einmal gescreent. Die Studie zeigte, dass das Risiko an Brustkrebs zu sterben bei den Teilnehmerinnen am Mammografie-Screening durchschnittlich um etwa 20% geringer war als in der Kontrollgruppe. Dagegen war die Sterblichkeit aufgrund anderer Ursachen in der Screening-Gruppe erwartungsgemäß ähnlich hoch wie in der Kontrollgruppe (s. Tabelle). Innerhalb der Screening-Gruppe gab es einen großen Unterschied bezüglich der Mortalität (außer Brustkrebs-Mortalität) zwischen den Frauen, die am Screening teilgenommen und denjenigen, die die Einladung nicht befolgt hatten:
Die geringere Sterblichkeit unter den Frauen, die am Screening teilgenommen hatten, ist nicht etwa auf das Screening zurückzuführen, sondern auf einen Selektionseffekt (Healthy Screenee-Effekt). Die teilnehmenden Frauen waren im Durchschnitt gebildeter, gesundheitsbewusster und besorgter über eine mögliche Krebserkrankung als die Frauen, die nicht daran teilnahmen. Sie stammten auch aus einer höheren sozialen Schicht und hatten aus all diesem Gründen eine niedrigere Mortalitätsrate.
Quelle: Fink et al. The reluctant participant in a breast cancer screening program. Public Health Reports 1968; 83: 479-490. Shapiro et al. Evidence on screening for breast cancer from a randomized trial. Cancer 1977; 39 (6):2772-2782.
Web-Box Überdiagnose: PSA-Screening (Ausführliche Version von Box 4.5.3 aus dem Lehrbuch)
In den USA wurde von 1993 bis 2001 die PLCO-Studie (Prostate, Lung, Colorectal, and Ovarian Cancer Screening Trial) durchgeführt. Ihr Ziel war es festzustellen, ob sich die Mortalität bei Prostata-, Lungen-, Ovarial- und kolorektalem Karzinom mit Hilfe von Krebs-Screening-Tests senken lässt. Beim PSA-Screening[1] wurden insgesamt 76.693 Männer zufällig entweder der Screening-Gruppe oder der Kontroll-Gruppe zugeordnet. Den Männern in der Screening-Gruppe wurden u.a. jährliche PSA-Tests und Tastuntersuchungen der Prostata über den Enddarm (digitale rektale Untersuchungen) angeboten, was 80 – 90% der Männer akzeptierten.
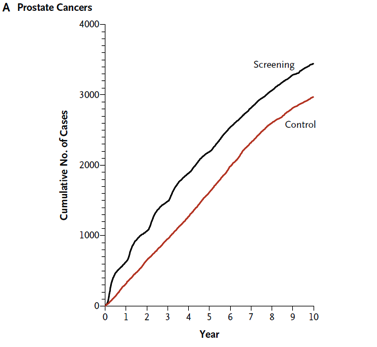
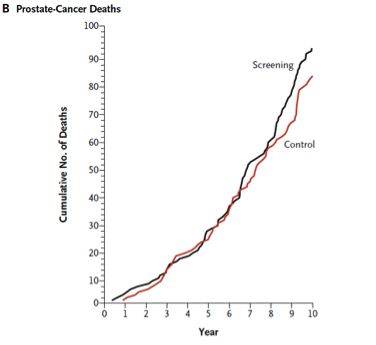
Die Resultate der Studie sind in den beiden unteren Abbildungen dargestellt. Abb. A zeigt, dass die Diagnosestellung durch das Screening im Durchschnitt etwa um 2 Jahre vorverschoben wurde. Man hätte allerdings erwartet, dass sich die Inzidenzkurve der Screening-Gruppe im Laufe der Zeit wieder derjenigen der Kontroll-Gruppe annähert, sodass dann in beiden Gruppen insgesamt gleich viele Fälle diagnostiziert würden. In der Screening-Gruppe blieb die Inzidenzrate jedoch über Jahre erhöht (relatives Risiko 1,22; 95%-VI 1,16 – 1,29). Der Grund hierfür ist das Phänomen der »Überdiagnose« – man geht davon aus, dass ein Teil der diagnostizierten Tumore nie klinisch manifest geworden wären. In derselben Zeit war die Sterblichkeit in beiden Gruppen vergleichbar (Abb. B). Das relative Risiko lag hier bei 1,13 und unterschied sich damit statistisch nicht signifikant von 1 (95%-VI 0,75 – 1,70).
Eine europäische Multicenter-Studie fand ebenfalls eine deutlich erhöhte Inzidenzrate in der Screening-Gruppe (relatives Risiko 1,71; 95%-VI 1,64 – 1,77) sowie eine statistisch knapp signifikante Abnahme der Sterblichkeit (relatives Risiko 0,80; 95%-VI 0,65 – 0,98). Auch in der Göteborg Studie war das Problem der Überdiagnose ausgeprägt, die Reduktion der Sterblichkeit war hier jedoch größer, insbesondere mehr als 10 Jahre nach der Randomisierung (relatives Risiko 0,56; 95%-VI 0,39 – 0,82). Die Unterschiede zwischen den Studien beruhen wahrscheinlich darauf, dass sich die Anzahl der Personen in den Kontrollgruppen unterschied, die zusätzlich ein opportunistisches Screening durchführen ließen. So weiß man, dass in der amerikanischen Studie bei etwa 50% der Studienteilnehmer in der Kontrollgruppe ein PSA-Screening durchgeführt wurde. Man vermutet, dass dieser Anteil z.B. in der europäischen Multicenter-Studie geringer war.
Aufgrund der Resultate dieser und ähnlicher Studien wird das PSA-Screening in Deutschland und der Schweiz sowie in vielen anderen Ländern nicht empfohlen. Die Evidenz wird jedoch kontrovers beurteilt. In der Praxis wird der Test trotzdem häufig durchgeführt.
Quellen: Andriole et al. Mortality Results from a Randomized Prostate-Cancer Screening Trial. N Engl J Med 2009;360:1310-9. Schröder et al. Screening and Prostate-Cancer Mortality in a Randomized European Study. N Engl J Med 2009;360:1320-8. Hugosson et al. Mortality results from the Göteborg randomized population-based prostate-cancer screening study. Lancet Oncol 2010;11:725-32.
[1] PSA= prostataspezifisches Antigen; PSA ist ein Enzym, das in den Ausführungsgängen der Prostata der Samenflüssigkeit beigemischt wird und daher natürlicherweise in der Samenflüssigkeit vorkommt. Ein hoher PSA-Wert geht jedoch meist auf eine (gut- oder bösartige) Veränderung der Prostata zurück. Da hohe PSA-Werte auch bei gutartigen Prostata-Veränderungen vorkommen, ist das PSA kein Tumormarker, sondern ein sog. Gewebemarker.
Internetquellen zum Thema
- Deutsches Krebsforschungszentrum. Krebsinformationsdienst. Krebsvorsorge und Krebsfrüherkennung.
- Deutsches Krebsforschungszentrum. Krebsinformationsdienst. Brustkrebs-Früherkennung: Mammographie-Screening und Abtasten.
- Krebsliga Schweiz. Früherkennung
- The US Preventive Services Task Force
- The UK National Screening Committee
- National Screening Unit (New Zealand)
(All accessed 24 October 2023)